Температура кипения и температура конденсации – Испарение, кипение, конденсация
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом.Испарениеиконденсацияявляются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако превращение газа в жидкость может происходить только при температурах ниже определенной, так называемой критической температурыTкр.Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, то есть к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация– это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, то есть когда скорости процессов испарения и конденсации одинаковы. Такую систему называютдвухфазной. Пар, находящийся в равновесии со своей жидкостью, называютнасыщенным.
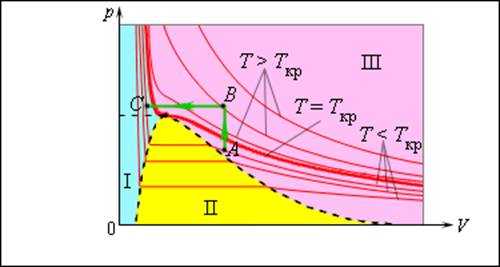
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема.Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 1.3.11).
1 |
Рисунок 1.3.11. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка. |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкрдля данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкрисчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки K. Один из возможных процессов такого рода показан на рис. 3.4.1 ломаной линией ABC.
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p0. Отношение p / p0, выраженное в процентах, называетсяотносительной влажностьювоздуха.
Ненасыщенный пар можно
теоретически описывать с помощью
уравнения состояния идеального газа
при обычных для реальных газов
ограничениях: давление пара должно быть
не слишком велико (практически
p ≤ (10
Давление p0насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p0(T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (то есть давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом,кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом
сосуде жидкость кипеть не может, т. к.
при каждом значении температуры
устанавливается равновесие между
жидкостью и ее насыщенным паром. По
кривой равновесия p
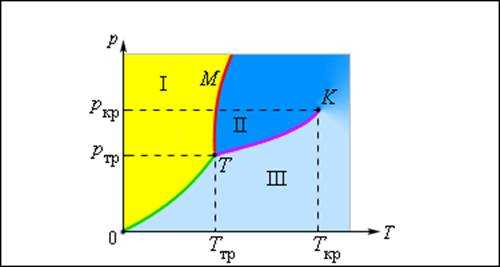
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, то есть фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого состояний любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0(T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 1.3.12). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
2 |
Рисунок 1.3.12. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. |
Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения,она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называетсякривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется
Для многих веществ давление pтрв тройной точке меньше 1 атм ≈ 105Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр= 273,16 К, pтр= 6,02·102Па. Эта точка используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтрпревышает 1 атм. Так для углекислоты (CO2) давление pтр= 5,11 атм и температура Tтр= 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С в твердом состоянии. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
МЕТОДИКА и ПОРЯДОК ИЗМЕРЕНИЙ
Внимательно рассмотрите рисунок и зарисуйте необходимое в свой конспект лабораторной работы.
Внимательно рассмотрите изображение на экране монитора компьютера. Обратите внимание на систему частиц, движущихся в замкнутом объеме слева во внутреннем окне. Они абсолютно упруго сталкиваются друг с другом и со стенками сосуда. Их количество N=100и данная система является хорошей «механической» моделью идеального газа. В процессе исследований можно останавливать движение всех молекул (при нажатии кнопки «» вверху) и получать как бы «мгновенные фотографии», на которых выделяются более ярким свечением частицы (точки), скорости которых лежат в заданном диапазонеvвблизи заданной скоростиv(т.е., имеющие скорости отvдоv+v). Для продолжения наблюдения движения частиц надо нажать кнопку «». Запишите в тетрадь значениеv, указанное на экране.
Получите у преподавателя допуск для выполнения измерений.
ИЗМЕРЕНИЯ
Нажмите кнопки «», «СТАРТ» и «ВЫБОР» и установите температуру Т1, указанную в таблице 1 для вашей бригады. Запишите для нее значение наивероятнейшей скорости.
Установите скорость выделенной группы молекул вблизи минимального заданного в таблице 2 значения.
Нажмите клавишу « » и подсчитайте на «мгновенной фотографии» количество молекулN, скорости которых лежат в заданном диапазонеvвблизи заданной скорости молекулv(они более яркие). Результат запишите в таблицу 2.
Нажмите кнопку «» и через 10-20 секунд получите еще одну мгновенную фотографию (нажав кнопку «»). Подсчитайте количество частиц с заданной скоростью. Результат запишите в табл.2.
Повторите еще 3 раза измерения для данной скорости и результаты запишите в табл.2.
Измените скорость до значения, указанного в табл.2, и сделайте по 5 измерений (как в пункте 4) для каждой скорости.
Установите (как в пункте 1) вторую температуру Т2 из табл.1. Запишите для нее значение наивероятнейшей скорости.
Повторите измерения (по пунктам 2,3,4,5), записывая результат в табл.3, аналогичную табл.2.
ТАБЛИЦА 1. Примерные значения температуры (не перерисовывать)
Бригада | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Т1 | 160 | 200 | 260 | 300 | 360 | 400 | 460 | 500 |
Т2 | 700 | 740 | 760 | 800 | 840 | 860 | 900 | 960 |
ТАБЛИЦЫ 2,3 Результаты измерений при T = ____ K
v[км/с]= | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 |
N1 | |||||||
N2 | |||||||
N3 | |||||||
N4 | |||||||
N5 | |||||||
NСР |
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЕТА:
Вычислите и запишите в таблицы средние значения количества частиц Nср, скорости которых лежат в данном диапазоне отvдоv+v.
Постройте на одном рисунке графики экспериментальных и теоретических зависимостей Nср отv. Теоретические зависимости можно срисовать с экрана монитора компьютера, подобрав соответствующий масштаб по вертикальной оси ординат.
Для каждой температуры определите экспериментальное значение наивероятнейшей скорости молекул vвер.
Постройте график зависимости квадрата наивероятнейшей скорости от температуры
По данному графику определите значение массы молекулы
.
Подберите газ, масса молекулы которого достаточно близка к измеренной массе молекулы.
Запишите ответы и проанализируйте ответы и графики.
studfiles.net
Парообразование и конденсация
понижение температуры возобновится, но только остывать уже будет образовавшееся твёрдое тело (участок F G).
Как показывает опыт, при кристаллизации на участке EF выделяется ровно то же самое количество теплоты Q = m, которое было поглощено при плавлении на участке BC.
Парообразование это переход жидкости в газообразное состояние (в пар). Существует два способа парообразования: испарение и кипение.
Испарением называется парообразование, которое происходит при любой температуре со свободной поверхности жидкости. Как вы помните из листка ¾Насыщенный пар¿, причиной испарения является вылет из жидкости наиболее быстрых молекул, которые способны преодолеть силы межмолекулярного притяжения. Эти молекулы и образуют пар над поверхностью жидкости.
Разные жидкости испаряются с разными скоростями: чем больше силы притяжения молекул друг к другу тем меньшее число молекул в единицу времени окажутся в состоянии их преодолеть и вылететь наружу, и тем меньше скорость испарения. Быстро испаряются эфир, ацетон, спирт (их иногда называют летучими жидкостями), медленнее вода, намного медленнее воды испаряются масло и ртуть.
Скорость испарения растёт с повышением температуры (в жару бельё высохнет скорее), поскольку увеличивается средняя кинетическая энергия молекул жидкости, и тем самым возрастает число быстрых молекул, способных покинуть её пределы.
Скорость испарения зависит от площади поверхности жидкости: чем больше площадь, тем большее число молекул получают доступ к поверхности, и испарение идёт быстрее (вот почему при развешивании белья его тщательно расправляют).
Одновременно с испарением наблюдается и обратный процесс: молекулы пара, совершая беспорядочное движение над поверхностью жидкости, частично возвращаются обратно в жидкость. Превращение пара в жидкость называется конденсацией.
Конденсация замедляет испарение жидкости. Так, в сухом воздухе бельё высохнет быстрее, чем во влажном. Быстрее оно высохнет и на ветру: пар сносится ветром, и испарение идёт более интенсивно.
В некоторых ситуациях скорость конденсации может оказаться равной скорости испарения. Тогда оба процесса компенсируют друг друга и наступает динамическое равновесие: из плотно закупоренной бутылки жидкость не улетучивается годами, а над поверхностью жидкости в этом случае находится насыщенный пар.
Конденсацию водяного пара в атмосфере мы постоянно наблюдаем в виде облаков, дождей и выпадающей по утрам росы; именно испарение и конденсация обеспечивают круговорот воды в природе, поддерживая жизнь на Земле.
Поскольку испарение это уход из жидкости самых быстрых молекул, в процессе испарения средняя кинетическая энергия молекул жидкости уменьшается, т. е. жидкость остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости (особенно при ветре), когда выходишь из воды: вода, испаряясь по всей поверхности тела, уносит тепло, ветер же ускоряет процесс испарения19.
Ту же прохладу можно почувствовать, если провести по руке кусочком ваты, смоченным в летучем растворителе (скажем, в ацетоне или жидкости для снятия лака). В сорокаградусную жару благодаря усиленному испарению влаги через поры нашего тела мы сохраняем свою температуру на уровне нормальной; не будь этого терморегулирующего механизма, в такую жару
19Теперь понятно, зачем мы дуем на горячий чай. Кстати сказать, ещё лучше при этом втягивать воздух в себя, поскольку на поверхность чая тогда приходит сухой окружающий воздух, а не влажный воздух из наших лёгких;-)
studfiles.net
Испарение и конденсация. Кипение жидкости – FIZI4KA

1. Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарения и кипения.
Испарение происходит с поверхности жидкости при любой температуре. Так, лужи высыхают и при 10 °С, и при 20 °С, и при 30 °С. Таким образом, испарением называется процесс превращения вещества из жидкого состояния в газообразное, происходящий с поверхности жидкости при любой температуре.
С точки зрения молекулярно-кинетической теории строения вещества испарение жидкости объясняется следующим образом. Молекулы жидкости, участвуя в непрерывном движении, имеют разные скорости. Наиболее быстрые молекулы, находящиеся на границе поверхности воды и воздуха и имеющие сравнительно большую энергию, преодолевают притяжение соседних молекул и покидают жидкость. Таким образом, над жидкостью образуется пар.
Поскольку из жидкости при испарении вылетают молекулы, обладающие большей внутренней энергией по сравнению с энергией молекул, остающихся в жидкости, то средняя скорость и средняя кинетическая энергия молекул жидкости уменьшаются и, следовательно, температура жидкости уменьшается.
Скорость испарения жидкости зависит от рода жидкости. Так, скорость испарения эфира больше, чем скорость испарения воды и растительного масла. Кроме того, скорость испарения зависит от движения воздуха над поверхностью жидкости. Доказательством может служить то, что бельё сохнет быстрее на ветру, чем в безветренном месте при тех же внешних условиях.
Скорость испарения зависит от температуры жидкости. Иапример, вода при температуре 30 °С испаряется быстрее, чем вода при 10 °С.
Хорошо известно, что вода, налитая в блюдце, испариться быстрее, чем вода такой же массы, налитая в стакан. Следовательно, скорость испарения зависит от площади поверхности жидкости.
2. Процесс превращения вещества из газообразного состояния в жидкое называется конденсацией.
Процесс конденсации происходит одновременно с процессом испарения. Молекулы, вылетевшие из жидкости и находящиеся над её поверхностью, участвуют в хаотическом движении. Они сталкиваются с другими молекулами, и в какой-то момент времени их скорости могут быть направлены к поверхности жидкости, и молекулы вернутся в неё.
Если сосуд открыт, то процесс испарения происходит быстрее, чем конденсация, и масса жидкости в сосуде уменьшается. Пар, образующийся над жидкостью, называется ненасыщенным.
Если жидкость находится в закрытом сосуде, то вначале число молекул, вылетающих из жидкости, будет больше, чем число молекул, возвращающихся в неё, но с течением времени плотность пара над жидкостью возрастет настолько, что число молекул, покидающих жидкость, станет равным числу молекул, возвращающихся в неё. В этом случае наступает динамическое равновесие жидкости с её паром.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром.
Если сосуд с жидкостью, в котором находится насыщенный пар, нагреть, то вначале число молекул, вылетающих из жидкости, увеличится и будет больше, чем число молекул, возвращающихся в неё. С течением времени равновесие восстановится, но плотность пара над жидкостью и соответственно его давление увеличатся.
3. В воздухе всегда содержится водяной пар, являющийся продуктом испарения воды. Содержание водяного пара в воздухе характеризует его влажность.
Абсолютной влажностью воздуха \( (\rho) \) называют массу водяного пара, содержащегося в 1 м3 воздуха, или плотность водяного пара, содержащегося в воздухе.
Если относительная влажность равна 9,41·10-3 кг/м3, то это означает, что в 1 м3 содержится 9,41·10-3 кг водяного пара.
Для того чтобы судить о степени влажности воздуха, вводят величину, называемую относительной влажностью.
Относительной влажностью воздуха \( (\varphi) \) называют величину, равную отношению плотности водяного пара \( (\rho) \), содержащегося в воздухе (абсолютной влажности), к плотности насыщенного водяного пара \( (\rho_0) \) при этой температуре:
\[ \varphi=\frac{\rho}{\rho_0}100\% \]
Обычно относительную влажность выражают в процентах.
При понижении температуры ненасыщенный нар может превратиться в насыщенный. Примером такого превращения является выпадение росы и образование тумана. Так, летним днём при температуре 30 °С плотность водяного пара равна 12,8·10-3 кг/м3. Этот водяной пар является ненасыщенным. При понижении вечером температуры до 15 °С он уже будет насыщенным, и выпадет роса.
Температуру, при которой водяной пар, содержащийся в воздухе, становится насыщенным, называют точкой росы.
Для измерения влажности воздуха используют прибор, называемый психрометром.
Психрометр состоит из двух термометров, один из которых сухой, а другой — влажный (рис. 74). Термометры прикреплены к таблице, в которой по вертикали указана температура, которую показывает сухой термометр, а по горизонтали — разность показаний сухого и влажного термометров. Определив показания термометров, по таблице находят значение относительной влажности воздуха.
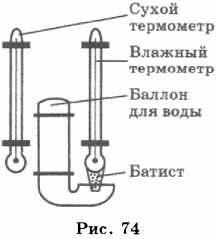
Например, температура, которую показывает сухой термометр, 20 °С, показание влажного термометра — 15 °С. Разность показаний 5 °С. По таблице находим значение относительной влажности \( \varphi \) = 59%.
4. Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
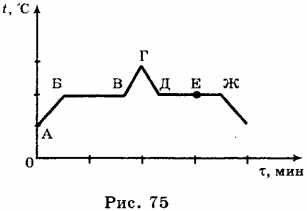
На рисунке 75 приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АБ), кипения (БВ), нагревания пара (ВГ), охлаждения пара (ГД), конденсации (ДЕ) и последующего охлаждения (ЕЖ).
5. Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельной теплотой парообразования \( (L) \) называют величину, равную отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — \( [L] \) = Дж/кг.
Чтобы рассчитать количество теплоты \( Q \), которое необходимо сообщить веществу массой \( m \) для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования \( (L) \) умножить на массу вещества: \( Q=Lm \).
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Испарение и кипение — два процесса превращения вещества из одного агрегатного состояния в другое. Общей характеристикой этих процессов является то, что оба они
А. Представляют собой процесс превращения вещества из жидкого состояния в газообразное
Б. Происходят при определённой температуре
Правильный ответ
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
2. Испарение и кипение — два процесса перехода вещества из одного агрегатного состояния в другое. Различие между ними заключается в том, что
А. Кипение происходит при определённой температуре, а испарение — при любой температуре.
Б. Испарение происходит с поверхности жидкости, а кипение — во всём объёме жидкости.
Правильным(-и) является(-ются) утверждение(-я)
1) только А
2) только Б
3) и А, и Б
4) ни А, ни Б
3. При нагревании вода превращается в пар той же температуры. При этом
1) увеличивается среднее расстояние между молекулами
2) уменьшается средний модуль скорости движения молекул
3) увеличивается средний модуль скорости движения молекул
4) уменьшается среднее расстояние между молекулами
4. В процессе конденсации водяного пара при неизменной его температуре выделилось некоторое количество теплоты. Что произошло с энергией молекул водяного пара?
1) изменилась как потенциальная, так и кинетическая энергия молекул пара
2) изменилась только потенциальная энергия молекул пара
3) изменилась только кинетическая энергия молекул пара
4) внутренняя энергия молекул пара не изменилась
5. На рисунке приведён график зависимости температуры воды от времени при её охлаждении и последующем нагревании. Первоначально вода находилась в газообразном состоянии. Какой участок графика соответствует процессу конденсации воды?
1) АВ
2) ВС
3) CD
4) DE
6. На рисунке приведён график зависимости температуры воды от времени. В начальный момент времени вода находилась в газообразном состоянии. В каком состоянии находится вода в момент времени \( \tau_1 \)?
1) только в газообразном
2) только в жидком
3) часть воды в жидком состоянии, часть — в газообразном
4) часть воды в жидком состоянии, часть — в кристаллическом
7. На рисунке приведён график зависимости температуры спирта от времени при его нагревании и последующем охлаждении. Первоначально спирт находился в жидком состоянии. Какой участок графика соответствует процессу кипения спирта?
1) АВ
2) ВС
3) CD
4) DE
8. Какое количество теплоты необходимо затратить, чтобы превратить в газообразное состояние 0,1 кг спирта при температуре кипения?
1) 240 Дж
2) 90 кДж
3) 230 кДж
4) 4500 кДж
9. В понедельник абсолютная влажность воздуха днём при температуре 20 °С была равной 12,8 г/см3. Во вторник она увеличилась и стала равной 15,4 г/см3. Выпала ли роса при понижении температуры до 16 °С, если плотность насыщенного пара при этой температуре 13,6 г/см3?
1) не выпала ни в понедельник, ни во вторник
2) выпала и в понедельник, и во вторник
3) в понедельник выпала, во вторник не выпала
4) в понедельник не выпала, во вторник выпала
10. Чему равна относительная влажность воздуха, если при температуре 30 °С абсолютная влажность воздуха равна 18·10-3 кг/м3, а плотность насыщенного пара при этой температуре 30·10-3 кг/м3?
1) 60%
2) 30%
3) 18 %
4) 1,7 %
11. Для каждого физического понятия из первого столбца подберите соответствующий пример из второго столбца. Запишите в таблицу выбранные цифры под соответствующими буквами.
ФИЗИЧЕСКИЕ ПОНЯТИЯ
A) физическая величина
Б) единица физической величины
B) прибор для измерения физической величины
ПРИМЕРЫ
1) кристаллизация
2) джоуль
3) кипение
4) температура
5) мензурка
12. На рисунке приведены графики зависимости от времени температуры двух веществ одинаковой массы, находившихся первоначально в жидком состоянии, получающих одинаковое количество теплоты в единицу времени. Из приведённых ниже утверждений выберите правильные и запишите их номера.
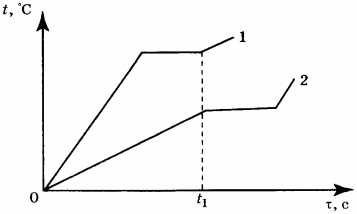
1) Вещество 1 полностью переходит в газообразное состояние, когда начинается кипение вещества 2
2) Удельная теплоёмкость вещества 1 больше, чем вещества 2
3) Удельная теплота парообразования вещества 1 больше, чем вещества 2
4) Температура кипения вещества 1 выше, чем вещества 2
5) В течение промежутка времени \( 0-t_1 \) оба вещества находились в жидком состоянии
Часть 2
13. Какое количество теплоты необходимо для превращения в стоградусный пар 200 г воды, взятой при температуре 40 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
Ответы
Испарение и конденсация. Кипение жидкости
Оценкаfizi4ka.ru
Температура кипения конденсации – Справочник химика 21
В задачу технической эксплуатации холодильной установки входит ее обслуживание — пуск, остановка, регулирование режима работы, который характеризуется температурами кипения, конденсации, переохлаждения, всасывания и нагнетания, поддержание заданного температурного режима в охлаждаемых объектах, подача хладоносителя в производственные цехи, устранение неисправностей в работе, проведение мелкого текущего ремонта оборудования, а также ведение учета работы холодильной установки. [c.310]Характеристики холодильных компрессоров сильно зависят от режима работы. В связи с этим холодопроизводительность, потребляемую мощность и энергетические коэффициенты компрессора указывают при определенных температурах кипения, конденсации, у входа в компрессор и переохлаждения. [c.33]
Программа определ яет температуру кипения (конденсации) и состав одной из фаз при заданных давлении и составе равновесной фазы смеси. Поскольку ири разработке программы выяснилось, что данный метод более чувствителен к выбору температуры кипения, чем к составу, итерационный расчет производится с корректировкой температуры, причем для это- [c.55]
Определение общего содержания примесей. К чистому ацетону прибавляют известные количества воды, метилового спирта и УКСУСНОЙ кислоты и отмечают дифференциальное изменение температуры кипения-конденсации чувствительность приблизительно до 0,001%. [c.359]
Определение содержания воды. Отмечают дифференциальное изменение температуры кипения-конденсации чувствительность до 0,001% Измеряют поглощение в инфракрасной области спектра при длине волны приблизительно 3 /и чувствительность выше 0,001%. [c.359]
В настоящее время введены понятия стандартной и рабочей холодопроизводительностей, определяемых четырьмя сравнительными температурами кипения, конденсации, переохлаждения, всасывания. Для стандартного режима при работе с аммиаком и хладонами приняты следующие температуры кипения-— 15 °С, конденсации 30, переохлаждения 25, всасывания соответственно— 10 и 15°С. [c.194]
Точки а и б на рис. 58 соответствуют температурам кипения (конденсации) чистых веществ. Нижняя кривая характеризует состав кипящей жидкости, верхняя—состав насыщенного пара ниже первой кривой—жидкая фаза, выше второй—перегретый пар, а между ними—смеси кипящей жидкости и насыщенного пара. Изотермы пересекают гетерогенную область в точках, отвечающих, составам равновесных фаз (например, л и к). [c.175]
Для учета температурного режима работы холодильной установки, а также расходов по технической эксплуатации ведут специальный журнал, в который регулярно записывают температуры кипения, конденсации и переохлаждения холодильного агента, воды для конденсатора, рассола в испарителях и воздуха в камерах. Кроме того, отмечают время пуска и остановки холодильных машин для определения продолжительности работы и расхода электроэнергии, смазки и охлаждающей воды. Указывают также о произведенных добавлениях холодильного агента в систему, спуске масла и воздуха, ремонте. Обычно на каждый день работы холодильной установки отводят отдельную страницу журнала. [c.257]
Следует установить, каким путем можно наиболее рационально контролировать прави-пьность степени открытия регулирующего вентиля. Если изобразить цикл холодильной машины (при всасывании в компрессор перегретого пара) в тепловой диаграмме (фиг. 105), то можно установить, что для осуществления этого цикла в определенных условиях внешних сред достаточно задать всего один независимый параметр или или tпараметры узловых точек цикла оказьшаются зависимыми, так как температуры кипения, конденсации и переохлаждения /3 самоустанавливаются в зависимости от условий внешней среды (часть параметров обусловливается характером процессов, из которых составлен цикл). [c.221]
При сравнении принимают температуры кипения, конденсации, всасывания, а также температуру жидкости перед регулирующим вентилем. [c.146]
Испытание ведут не менее часа в установившемся тепловом режиме, поддерживая заданные температуры кипения, конденсации и температуру всасывания 15°. [c.85]
Холодопроизводительность компрессора Qo с теоретической производительностью Ут определяется выбранным циклом и зависит от температур кипения конденсации и температуры перед регулирующим вентилем [c.59]
Очищенный коксовый газ далее можно подвергать разделению. Наиболее удобным методом разделения коксового газа является фракционированная конденсация его компонентов. Температуры кипения (конденсации) составных частей коксового газа (при 760 мм рт. ст.) приведены ниже [c.155]
Температура нагнетания зависит в основном от температуры кипения, конденсации и величины перегрева пара на всасывании. По правилам техники безопасности температура нагнетания для аммиачных тихоходных горизонтальных компрессоров не должна превышать 135 С, а для блок-картерных и оппозитных— не выше 150 . Температура нагнетания у поршневых компрессоров, работающих на фреоне-12, допускается не выше 125 С. Для ротационных компрессоров на аммиаке и фреоне-22 максимально допустимые температуры нагнетания не должны превышать 110°С для винтовых компрессоров на аммиаке 105°С, на фреоне-22 ЭО°С. [c.57]
Вид диаграммы температура — состав определяется следующими соображениями. При данном давлении более летучий компонент будет обладать меньшей температурой кипения минимум на диаграмме Р — N отвечает максимуму на диаграмме I — N , наоборот, максимум на диаграмме Р — N отвечает минимуму на диаграмме I — N. Таким образом, точки аиб соответствуют температурам кипения (конденсации) чистых веществ. Нижние кривые характеризуют состав кипящей жидкости, верхние — состав насыщенного пара ниже первых из них — жидкая фаза, выше вторых — перегретый пар, а между ними — смеси кипящей жид- [c.103]
Температура нагнетания зависит в основном от температуры кипения, конденсации и величины перегрева пара на всасывании. Чем выше температура конденсации и ниже температура кипения, больше перегрев пара на всасывании, тем выше температура нагнетания. При нормальной работе компрессора действительная температура нагнетания близка к теоретической, получающейся при адиабатическом сжатии сухих насыщенных паров холодильного агента, так как количество тепла, подводимого к пару в процессе сжатия и отводимого от компрессора в охлаждающих устройствах, приблизительно равно. [c.50]
Отмеченные особенности приводят к тому, что холодильная машина с одним и тем же компрессором и постоянным Уд дает при разных температурах / и неодинаковую холодопроизводительность . На рис. 61 показан характер изменения Qo в зависимости от при работе фреоновых и аммиачных холодильных машин. Коэффициент подачи X зависит также от конструкции компрессора и величины мертвого объема. Для заданного компрессора или ряда машин одинаковой конструкции можно считать, что X зависит только от температурного режима холодильного цикла. Тогда из формулы (V—6 следует, что холодопроизводительность машин, осуществляющих один и тот же термодинамический цикл в одинаковых температурных условиях, будет прямо пропорциональна объему 1/ , описанному поршнем компрессора. Основываясь на этом, можно, условившись заранее об одном фиксированном цикле с определенными значениями температур кипения, конденсации и перед регулирующим вентилем, по величине У, судить о холодопроизводительности машины. [c.178]
Холодопроизводительность брутто — количество теплоты, отводимой холодильным агентом в заданных условиях работы температуры кипения, конденсации, перегрев пара в испарителе, наличие или отсутствие регенеративного теплообмена между жидким и парообразным холодильным агентом. [c.195]
Статическая характеристика ТРВ отражает его свойства только при определенных условиях работы, т. е. при некоторых выбранных значениях температур кипения, конденсации, переохлаждения жидкости. Эти условия принято называть специфи-кационными. [c.85]
При обслуживании холодильной установки персонал регулярно заполняет суточный журнал по эксплуатации. В него заносят время пуска и остановки оборудования, Температуру в холодильных камерах и основные параметры режимов работы установки (температуры кипения, конденсации, всасывания, нагнетания и т. д.). Кроме того, указывают все проведенные работы, количество заправленного масла,, все обнаруженные неисправности и принятые меры. На основании суточного журнала по эксплуатации составляют журнал наработки часов за месяц компрессора, насоса, вентилятора, журнал наработки часов за год и журнал учета отказов (см. приложение 3). [c.180]
Показания приборов записывают каждые 10 мин в течение 1 ч после того, как режим работы полностью установится (установившимся считают режим, при котором отклонения температур кипения, конденсации и воздуха перед конденсатором от среднего значения не превосходят 0,5° С). Отклонения напряжения на клеммах агрегата во время испытаний не должны превышать 1%. [c.198]
Холодопроизводительность агрегатов указана при несколько иных условиях, чем холодопроизводительность компрессора. У компрессоров заданы температуры кипения, конденсации, всасывания, а также расчетная температура переохлаждения. У агрегатов приведены в номинальном режиме температуры кипения, окружающего воздуха или охлаждающей воды, всасывания, а также действительная температура переохлаждения. [c.253]
На рис. XVI1-9 изображена схема каскадного цикла, являющегося сочетанием дйух холодильных циклов. Оба цикла объединяются общим теплообменником /, называемым испарителем-конденсатором. В нижнем холодильном цикле каскада (компрессор // и конденсатор ///) применяется хладоагент с низкой температурой кипения, конденсация которого происходит в испарителе-конденсаторе за счет отнятия тепла кипящим хладоагентом перхнего холодильного цикла (компрессор /К и конденсатор 1 ). [c.661]
Разная склонность компонентов смеси к переходу в парообразное (либо жидкое) состояние обусловлена разницей их температур кипения (конденсации). Так, при атмосферном давлении температура кипения метанола равна 64,5 °С, а воды — 100 °С бензола — 80,2 °С, а толуола — 110,6 °С. Очевидно, чго метанол в первой из смесей и бензол — во второй будут прояЕлять большее стремление перейти из жидкой фазы в паровую, а вода и толуол — из паровой в жидкую. [c.969]
Месячный отчет по эксплуатации составляют на основании записей в журнале по среднемесячным условиям работы каждого компрессора с вьнислением рабочей производительности по температурам кипения, конденсации и переохлаждения. [c.257]
Оптимальный режим обеспечивает при установленных температурах кипения, конденсации и охлаждающей воды получение наибольщего теплового коэффициента. Указанным температурам соответствует оптимальные температура нагрева раствора в кипятильнике и концентрация слабого раствора. Осуществление оптимального режима возможно лишь в том случае, если установка может быть обеспечена паром соответствующих параметров. При заданных температурах кипения и конденсации холодильного агента удельная весовая холодопроизводительность будет постоянной. Следовательно, наибольшая величина коэффициента соответствует наименьшему значению теплоты выпаривания. Напомним, что теплота выпаривания определяется следующим выражением [c.286]
Теплотехнические испытания судовых холодильных установок рекомендуется производить при установившемся тепловом режиме, когда все температуры, давления, влажность воздуха, частота вращения и все другие параметры испытуемого контура и холодильной установки поддерживаются по возможности неизменными. Колебания температур кипения, конденсации и переохладения жидкого холодильного агента допускаются до 0,5°С, а разности температур воды и рассола до и после аппаратов до — 5% от среднего значения разности температур. [c.211]
Здесь Тц, Т и Т —абсолютные температуры кипения, конденсации и конца )диабатного сжатия. [c.193]
Точки а и б на рис. 62 соответствуют температурам кипения (конденсации) чистых веществ. Нижняя кривая характеризует состав кипящей жидкости, верхняя — состав насыщенного нара ниже первой кривой — жидкая фазе, выше второй — перегретый пар, а между ними — смеси кипящой жидкости и насыщенного пара. Изотермы пересекают гетерагенную область в точках, отвечающих составам равновесных фаз (например, лик) . [c.161]
chem21.info
Испарение, кипение и конденсация жидкостей — КиберПедия
В жидком состоянии вещество может существовать в определённом интервале температур. При температуре, меньшей нижнего значения этого интервала, жидкость превращается в твёрдое вещество. А если значение температуры превысит верхнюю границу интервала, жидкость переходит в газообразное состояние.
Процесс превращения вещества в пар называют парообразованием. Обратный процесс перехода из пара в жидкость – конденсация.
Парообразование происходит в двух случаях: при испарении и при кипении.
Испарением называют фазовый процесс перехода вещества из жидкого состояния в газообразное или парообразное, происходящий на поверхности жидкости.
Как и при плавлении, при испарении веществом поглощается теплота. Она затрачивается на преодоление сил сцепления частиц (молекул или атомов) жидкости. Кинетическая энергия молекул, обладающих самой высокой скоростью, превышает их потенциальную энергию взаимодействия с другими молекулами жидкости. Благодаря этому они преодолевают притяжение соседних частиц и вылетают с поверхности жидкости. Средняя энергия оставшихся частиц становится меньше, и жидкость постепенно остывает, если её не подогревать извне.
Так как частицы находятся в движении при любой температуре, то и испарение также происходит при любой температуре. Мы знаем, что лужи после дождя высыхают даже в холодную погоду.
Но скорость испарения зависит от многих факторов. Один из важнейших – температура вещества. Чем она выше, тем больше скорость движения частиц и их энергия, и тем большее их количество покидает жидкость в единицу времени.
Испарение происходит и в твёрдых телах. Мы видим, как постепенно высыхает на морозе замёрзшее, покрытое льдом бельё. Лёд превращается в пар. Мы ощущаем резкий запах, образующийся при испарении твёрдого вещества нафталина.
Некоторые вещества вообще не имеют жидкой фазы. К примеру, элементарный иод I2 – простое вещество, представляющее собой кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, при нормальных условиях сразу же превращается в газообразный иод – фиолетовые пары с резким запахом. Тот жидкий йод, который мы покупаем в аптеках, – это не жидкое его состояние, а раствор йода в спирте.
Процесс перехода твёрдых тел в газообразное состояние, минуя жидкую стадию, называют сублимацией,или возгонкой.
Кипение – это тоже процесс перехода жидкости в пар. Но парообразование при кипении происходит не только на поверхности жидкости, но и по всему её объёму. Причём процесс этот проходит гораздо интенсивнее, чем при испарении.
Испарение происходит при любой температуре, а кипение – только при определённой температуре, которая называется температурой кипения.
Каждое вещество имеет свою температуру кипения. Она зависит от величины давления. При нормальном атмосферном давлении вода закипает при температуре 100оС, спирт – при 78 оС, железо – при 2750 оС. А температура кипения кислорода – минус 183 оС.
При уменьшении давления температура кипения снижается. В горах, где атмосферное давление ниже, вода закипает при температуре менее 100 оС. И чем выше над уровнем моря, тем меньшей будет температура кипения. А в кастрюле-скороварке, где создаётся повышенное давление, вода закипает при температуре выше 100 оС.
Если вещество может одновременно существовать в жидкой (или твёрдой) фазе и газообразной, то его газообразное состояние называют паром. Пар образуют молекулы, вылетевшие при испарении из жидкости или твёрдого вещества.
Нальём жидкость в сосуд и плотно закроем его крышкой. Через некоторое время количество жидкости уменьшится из-за её испарения. Молекулы, покидающие жидкость, будут концентрироваться над её поверхностью в виде пара. Но когда плотность пара станет довольно высокой, некоторые из них начнут снова возвращаться в жидкость. И таких молекул будет всё больше и больше. Наконец, настанет такой момент, когда число молекул, вылетающих из жидкости, и число молекул, возвращающихся в неё, сравняется. В этом случае говорят, что жидкость находится в динамическом равновесии со своим паром. А такой пар называется насыщенным.
Если при парообразовании из жидкости вылетает больше молекул, чем возвращается, то такой пар будет ненасыщенным.
Ненасыщенный пар образуется, когда испаряющаяся жидкость находится в открытом сосуде. Покидающие её молекулы рассеиваются в пространстве. Возвращаются в жидкость далеко не все из них.
Обратный переход вещества из газообразного состояния в жидкое называют конденсацией. При конденсации часть молекул пара возвращается в жидкость.
Пар начинает превращаться в жидкость (конденсироваться) при определённом сочетании температуры и давления. Такое сочетание называется критической точкой.
Максимальная температура, ниже которой начинается конденсация, называется критической температурой. При температуре выше критической газ никогда не превратится в жидкость.
В критической точке граница раздела фазовых состояний жидкость-пар размывается. Исчезает поверхностное натяжение жидкости, выравниваются плотности жидкости и её насыщенного пара. При динамическом равновесии, когда число молекул, покидающих жидкость и возвращающихся в неё равно, процессы испарения и конденсации уравновешены.
При испарении воды её молекулы образуют водяной пар, который смешивается с воздухом или другим газом.
Температура, при которой такой пар в воздухе становится насыщенным, начинает конденсироваться при охлаждении и превращается в капельки воды, называется точкой росы.
Иногда вещество может перейти из газообразного состояния сразу в твёрдое, минуя жидкую стадию. Такой процесс называется десублимацией. Ледяные узоры, которые появляются на стёклах в мороз, и есть пример десублимации. При заморозках почва покрывается инеем – тонкими кристалликами льда, в которые превратились водяные пары из воздуха.
Теплота испарения по своей величине равна теплоте конденсации и зависит от температуры и давления процесса, уменьшаясь с приближением их критическим величинам
Конденсация процесс перехода вещества из парообразного состояния в жидкое;
При конденсации резко уменьшается объем среды и образуется вакуум.
Кавитация.
Кавита́ция — процесс парообразования и последующего схлопывания пузырьков пара с одновременным конденсированием пара в потоке жидкости, сопровождающийся шумом и гидравлическими ударами, образование в жидкости полостей (кавитационных пузырьков, или каверн), заполненныхпаром самой жидкости, в которой возникает.
При увеличении скорости жидкости давление в ней падает. Если абсолютное давление при этом достигает значения равного давлению насыщенных паров при данной температуре, то в данном месте начинается кипение, выделение паров и газов. Такое явление называется кавитацией.
Кавитация – это местное нарушение сплошности течения с образованием паровых и газовых пузырей (каверн) обусловленное местным падением давления в потоке.
Именно, кавитация является определяющими фактором для величины высоты всасывания насоса, т.к чем больше высота всасывания – тем большее разряжение нужно создать, чтобы закачать жидкость в насос, как только величина этого разряжения приблизится к значению давления насыщенных паров возникнет неблагоприятный эффект – нарушение сплошности потока – кавитацию.
Кавитация сопровождается характерным шумом, а при длительном воздействии также эрозионным разрушением металлических стенок. Дело в том, что в центрах захлопывающихся пузырьков давление подскакивает до 1500 ¸ 2000 ат, а температуры – до1000 ¸ 1500°С. От мгновенного разрушения гидросистему спасает только то, что объемы, в которых наблюдаются такие параметры, микроскопически малы, а распространяясь по жидкости давление и температура очень быстро падают.
Но если пузырек захлопывается на поверхности трубы или гидроагрегата, то высокое давление и температура воздействуют на металл и разрушают его, выкрашивают.
Механическое воздействие сопровождается химическим, так как в растворенном воздухе процент содержания кислорода существенно выше, чем в атмосферном, так как кислород растворяется в жидкостях лучше, чем азот.
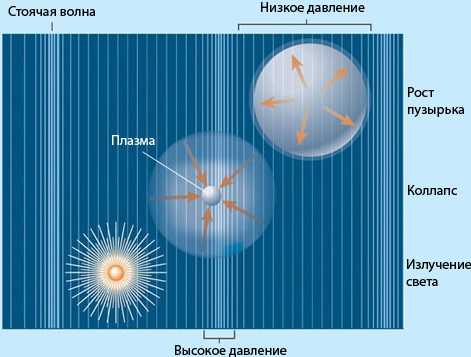
Схлопывание кавитационных пузырей приводит к тому, что энергия окружающей жидкости сосредотачивается в очень небольших объёмах.
Тем самым, образуются места повышенной температуры и возникают ударные волны, которые являются источниками шума и приводят к эрозии металла. Шум, создаваемый кавитацией, является особой проблемой на подводных лодках, так как снижает их скрытность.
Кавитация ведёт к большому износу рабочих органов и может значительно сократить срок службы винта и насоса. В метрологии, при использовании ультразвуковых расходомеров, кавитационные пузыри модулируют волны в широком спектре, в том числе и на частотах излучаемых расходомером, что приводит к искажению его показаний.
Хотя кавитация нежелательна во многих случаях, есть исключения. Например, сверхкавитационные торпеды, используемые военными, обволакиваются в большие кавитационные пузыри. Существенно уменьшая контакт с водой, эти торпеды могут передвигаться значительно быстрее, чем обыкновенные торпеды. Так сверхкавитационная торпеда «Шквал», в зависимости от плотности водной среды, развивает скорость до 370 км/ч.
Кавитация используется при ультразвуковой очистке поверхностей твёрдых тел. Специальные устройства создают кавитацию, используя звуковые волны в жидкости. Кавитационные пузыри, схлопываясь, порождают ударные волны, которые разрушают частицы загрязнений или отделяют их от поверхности. Таким образом, снижается потребность в опасных и вредных для здоровья чистящих веществах во многих промышленных и коммерческих процессах, где требуется очистка как этап производства.
В промышленности кавитация часто используется для гомогенизации (смешивания) и отсадки взвешенных частиц в коллоидном жидкостном составе, например, смеси красок или молоке.Многие промышленные смесители основаны на этом принципе.
Кавитацию используют для обработки топлива. Во время обработки топливо дополнительно очищается (при проведении химического анализа сразу обнаруживается существенное уменьшение количества фактических смол)[2], и перераспределяется соотношение фракций (в сторону более лёгких). Их проводят частные компании и институты, например Российский государственный университет нефти и газа им. И. М. Губкина.
Также были разработаны кавитационные водные устройства очистки, в которых граничные условия кавитации могут уничтожить загрязняющие вещества и органические молекулы. Спектральный анализ света, испускаемого в результате сонохимической реакции, показывает химические и плазменные базовые механизмы энергетической передачи. Свет, испускаемый кавитационными пузырями, называется сонолюминесценцией.
Кавитационные процессы имеют высокую разрушительную силу, которую используют для дробления твёрдых веществ, которые находятся в жидкости. Одним из применений таких процессов является измельчение твёрдых включений в тяжёлые топлива, что используется для обработки котельного топлива с целью увеличения калорийности его горения.
cyberpedia.su
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (≈ 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
скриншот игры про испарение и конденсацию (на крыше)
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе (рис. 3.4.1).
|
Рисунок 3.4.1. Изотермы реального газа. Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка |
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
Если изотермически сжимать ненасыщенный пар при T < Tкр, то его давление будет возрастать, пока не станет равным давлению насыщенного пара. При дальнейшем уменьшении объема на дне сосуда образуется жидкость и устанавливается динамическое равновесие между жидкостью и ее насыщенным паром. С уменьшением объема все большая часть пара конденсируется, а его давление остается неизменным (горизонтальный участок на изотерме). Когда весь пар превращается в жидкость, давление резко возрастает при дальнейшем уменьшении объема вследствие малой сжимаемости жидкости.
Из газообразного состояния в жидкое можно перейти, минуя двухфазную область. Для этого нужно совершить процесс в обход критической точки K. Один из возможных процессов такого рода показан на рис. 3.4.1 ломаной линией ABC.
В атмосферном воздухе всегда присутствуют пары воды при некотором парциальном давлении p, которое, как правило, меньше давления насыщенного пара p0. Отношение p / p0, выраженное в процентах, называется относительной влажностью воздуха.
Ненасыщенный пар можно теоретически описывать с помощью уравнения состояния идеального газа при обычных для реальных газов ограничениях: давление пара должно быть не слишком велико (практически p ≤ (106–107) Па), а его температура выше некоторого определенного для каждого вещества значения. К насыщенному пару также можно приближенно применять законы идеального газа при условии, что для каждой температуры T давление p0 насыщенного пара определяется по кривой равновесия p0(T) для данного вещества.
Давление p0 насыщенного пара очень быстро возрастает с ростом температуры T. Зависимость p0 (T) нельзя получить из законов идеального газа. Давление газа при постоянной концентрации молекул растет прямо пропорционально температуре. В насыщенном паре при повышении температуры возрастает не только средняя кинетическая энергия движения молекул, но и их концентрация. Поэтому давление насыщенного пара при повышении температуры возрастает быстрее, чем давление идеального газа при постоянной концентрации молекул.
Испарение может происходить не только с поверхности, но и в объеме жидкости. В жидкости всегда имеются мельчайшие пузырьки газа. Если давление насыщенного пара жидкости равно внешнему давлению (т. е. давлению газа в пузырьках) или превышает его, жидкость будет испаряться внутрь пузырьков. Пузырьки, наполненные паром, расширяются и всплывают на поверхность. Этот процесс называется кипением. Таким образом, кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров становится равным внешнему давлению.
В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это значит, что при такой температуре давление насыщенных паров воды равно 1 атм. При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
В герметически закрытом сосуде жидкость кипеть не может, т. к. при каждом значении температуры устанавливается равновесие между жидкостью и ее насыщенным паром. По кривой равновесия p0 (T) можно определять температуру кипения жидкости при различных давлениях.
Изображенная на рис. 3.4.1 картина изотерм реального газа описывает процессы испарения и конденсации, т. е. фазовый переход между газообразной и жидкой фазами вещества. На самом деле эта картина является неполной, т. к. из газообразного и жидкого любое вещество может перейти в твердое состояние. При заданной температуре T термодинамическое равновесие между двумя фазами одного и того же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия. Примером может служить кривая равновесия p0 (T) насыщенного пара и жидкости. Если кривые равновесия между различными фазами данного вещества построить на плоскости (p, T), то они разбивают эту плоскость на отдельные области, в которых вещество существует в однородном агрегатном состоянии – твердом, жидком или газообразном (рис. 3.4.2). Изображенные в координатной системе (p, T) кривые равновесия называются фазовой диаграммой.
|
Рисунок 3.4.2. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество |
Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Для многих веществ давление pтр в тройной точке меньше 1 атм ≈ 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).
www.its-physics.org
Спирт этиловый температура конденсации
Области применения сложных эфиров в технике и народном хозяйстве
Раскройте биологическую роль сложных эфиров в живой природе?
Нужно похимии применение (сложных) эфиров в картинках
Http://slovari.yandex.ru/dict/krugosvet/article/a/ad/1012089.htm
http://slovari.yandex.ru/dict/krugosvet/article/a/ad/1012089.htm
http://www.do.rksi.ru/library/courses/him10/lec10_5_1.dbk
http://www.eapo.org/rus/bulletin/ea200604/HTML/007178.html
2. Спирт этиловый. Основы ректификации. 3. Определение концентрации спирта.Т.е., чем больший процент спирта в смеси, тем температура кипения будет ближе к 78,80С, и наоборот – слабые4. Конденсатор – холодильник для полной конденсации паров, выходящих из РК.
Помогите, пожалуйста нужна температура конденсации этилового спирта при атм давлении
При одинаковом давлении температура кипения и температура конденсации одного и того же вещества одинаковы.
78,4 °C
Рис.3 Зависимость температуры кипения этилового спирта-ректификата от атмосферного давления Если Вы эксплуатируете ректификационнуюОбразовавшийся в кубе пар по патрубку попадает в конденсатор-охладитель, где происходит его конденсация и охлаждение.
Виделить Спирт из браги ?
Самогон… самогоноварение.. подстатейное дело. . ))
Температура кипения 64,509о С. Бесцветная жидкость. Этиловый спирт.Температура конденсации паров дистиллята tD 65,5о C. Температуру воды на входе в теплообменник примем 180С, на выходе 380С.
В учебнике химии за. . кажись 9-й класс, возгонная установка, короче классический самогонный аппарт
Испаритель + конденсатор. Испаритель = емкость, обычно цилиндрическая, заполняемая брагой обычно на 2/3 объема. Конденсатор = змеевик, или трубка + кожух с циркулирующей в ней водой. Стеклянный, я знаю, можно купить в магазине. Самогоноприемник = банка, стакан, рот и др.
Единственная сложность, если время самогоноотделения жестко не задано, – это расчет мощьности конденсатора, но его можно сделать, опираясь на интуицию, как наши дедушки делали.
Экспериментируйте. Но помните, что самогон как нефь. В смысле наличия в нем огромного спектра других веществ, в своем большинстве вредных для здоровья. Не употребляйте его по назначению, эту гадость. В наше время есть и другие, более легкие пути навредить здоровь. И что касаетс максимальной концентрации этанола в самогоне: гнать можно только до азеотропа, состав которого зависит от давления. Изменяя давление, можно изменять состав азеотропа. А можно использовать просто осушители. Но зачем вам все это говно?
Посмотри здесь [ссылка заблокирована по решению администрации проекта] или здесь http://www.kleoclub.org/files/samogon3.htm . А вообще принципа очень простой: при нагревании спирт из браги испаряется (его температура испарения не очень высока) , затем пары поступают в такую емкость, где охлаждаются и конденсируются (превращаются в жидкость) . Таким образом отделяют многие вещества от примесей (не только спирт).
У меня есть книга: Руководство по ректификации спирта, там все по науке
Но лучше ответа “Татьяны Гусевой”вряд ли можно что-то предложить
Брагу в кулек и на мороз,что не замерзло пей
Конденсация спирта предполагается при атмосферном давлении, жидкий спирт отводится при температуре конденсации. посмотреть решение этой задачи. 4.19. Кожухотрубчатый противоточный теплообменник рис. 4.21 …
Перспективные перегонные аппараты
Для тех, кто собирается не только изготовить определенное количество горячительного, а и побороться за отличное его качество, рекомендуем изготовить и испытать на практике перегонный аппарат, приведенный на данном рисунке. Этот аппарат мало чем отличается от аппарата, описанного ранее, но в нем между выпарной емкостью и холодильником с проточной водой установлен дефлегматор с воздушным охлаждением. В первичной камере за счет охлаждения пара воздухом происходит конденсация более тяжелых фракций (с температурой кипения более 80°С) , которые стекают обратно в выпарную емкость. В верхней части дефлегматора конденсируется жидкость с температурой кипения около 78°С (собственно этиловый спирт) , вот она-то и стекает в холодильник, а затем и сборник готовой продукции.
[ссылка заблокирована по решению администрации проекта]
Как заставите Сгнегурочку таять?)
Надо пописать ей в рот
С водой дает азеотропную смесь, содержащую 95,6% спирта и кипящую при температуре 78,10С. В виде такого ректификата этиловыйОднако с целью предотвращения конденсации водяного пара в самом реакторе, что приводит к разбавлению фосфорной кислоты и…
В микроволновке
В костер ее, сама растает!
Точно, в костер ее!!!!
Лаской и поцелуями
Полизать, но смотри -приготовь теплую воду на случай если язык прилипнет!
Температура кипения 64,509о С. Бесцветная жидкость. Этиловый спирт.Температура конденсации паров дистиллята tD 65,5о C. Температуру воды на входе в теплообменник примем 180 С, на выходе 380 С.
А ты ее поджарь…. хорошенько….
Ох братья физики, помогите! Когда в машине сидит выпивший (народная примета), окна потеют. А с чего это они потеют.
Перегар потомучто
Это относится и к температуре кипения температура кипения понижается от первичных спиртов к третичным.Ацетальдегид, образующийся при окислении этилового спирта, этой реакции не дает, так как способность к реакции конденсации у него очень мала.
Если объяснять на пальцах, то у этилового спирта точка росы ниже, чем у воды. Поэтому пары этанола конденсируются на холодном стекле. А уже капли этанола “притягивают” пары Н2О, образуя туман на стеклах.
Простой конденсат, когда с одной стороны стекла холодно, а с другой тепло, выхлоп рождается в организме, из летучей жидкости.. . алкоголь сам по себе этиловый спирт.. . летучие пары выходят, и получается, что весь свободный кислород занят.. . воздух становиться спертым в железном ведре с окнами…. а когда трезвый если не будешь обдув включать так же будет…. потому что возникает разница температур))) ) и не куда не уйдешь от этого))
Алкаголик всегда горячий и потный а улица холодная и стекло с двух сторон разная температура вот и получается
Просто выпивший слишком часто открывает свой рот. тут тебе и конденсация, и парообразование, и улетучивание спиртов, и загрязнение окружающей среды)))
Ему жарко и он потеет!
Холодный воздух поглощает меньше влаги, чем теплый воздух, и теплый поэтому более насыщен влагой. Если же сейчас этот теплый воздух соприкоснётся с чем-то холодным (окна зимой всегда холодны, так как не могут сохранить тепло) то он охлаждается и освобождает влагу.
Тёплый, насыщенный влагой воздух должен выйти из машины, а холодный, сухой воздух войти. Так что спускайте окна, вместо включения печки!
, где СА, СВ теплоемкости метилового спирта и этилового спирта при температуре с.562 1 .Кубовый остаток кипит при 770С. Согласно заданию, температура конденсации греющего пара равна 1000С р 1,03 кгс см2 .
Не верьте в народные приметы. Эту шутку когда-то придумал какой-то хохмач, как в случае со страусом сующим голову в песок. В ПРЕРИЯХ! Просто надо включить обдув стекол в холодную или ненастную погоду. Почему стекла “потеют” в такую погоду, вы, как физик, думаю, разберетесь.
Зачем при изготовлении самогона охлаждение водой частей змеевика
Для выпадения паров спирта в росу
На этиловый спирт синтетический ГОСТ 9674-61. Температура воспламенения 13 С, температура самовоспламенения 404 СДля предотвращения конденсации водяного пара парциальное давление последнего, а значит и общее давление должно быть ниже.
Что бы пары самогона конденсировали
Можно без воды, но теплообменник будет сильно больше.
Потому что только змеевик и служит для охлаждения жидкости.
Сейчас зима, снег будет эффективнее.
А самогон-чище.
Для повышения его КПД
Ставляет собой азеотропную смесь этилового спирта с водой 95,57% спирта с температурой кипения 78,15ОС .При частичной конденсации паро-вой фазы образующийся дистиллят имеет температуру кипения выше темпера-туры конденсации пара.
После того как микроорганизмы и грибки переработают еду в виде различных сахаров и выделят при этом продукт жизнедеятельности в том числе и этиловый спирт. Этот раствор содержит небольшой % этанола тоесть бражка. Но поскольку бражка невкусная (если это не пиво) то надо выделить этанол. Один из методов разделения хим веществ это термическое разделение на основе разницы в температуре испарения веществ. Потому ёмкость из бражкой нагревают до кипения при этом испаряется этанол, вода и некоторые сивушные масла. И чтобы сконденсировать пар у жидкость надо его охладить, тоесть понизить температуру точки росы https://ru.wikipedia.org/wiki/Точка_росы при охлаждении, пар становится насыщенным и конденсируется у жидкость. Можно вместо охлаждения использовать сильное давление при котором образовавшийся пар будет нагнетаться у ёмкость под большим давлением где он сам сконденсируется. Охлаждать трубку из паром можно воздухом или жидкостью, Дистилят будет иметь уже повышенное содержание спирта у сравнении из бражкой. Если дистилят ещё раз перегнать то % спирта у вторичном дистиляте немного повысится но последующие перегонки дадут азеотропную смесь https://ru.wikipedia.org/wiki/Азеотропная_смесь И чтобы из азеотропной смеси воды и спирта выделить более чистый спирт нужно применять перегонку из водоотнимающими веществами при которых вода будет химически связана и не попадёт у дистилят. Но самый чистый 100% этанол он гигроскопичен и будет хавать воду из воздуха…. Но для обычных домашних самогонщиков эта вся заумь до жопы.
Насколко ето реално? в домашних условиях? подскажите где наити 4ертежи етои установки ?
Точно так-же как и дистилированую воду делают!!!!потом добавляют абсорбирующие добавки для удаления сивушных масел….
В первичной камере за счет охлаждения пара воздухом происходит конденсация более тяжелых фракций с температурой кипения более 80 С , которые стекаютВ третьем положении, настройкой резистора R4.3 устанавливается температура испарения этилового спирта.
Реально. Ищите по теме “Самогонный аппарат”.
Какая температура кипения песка?
Температу́ра плавле́ния и отвердева́ния — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества. На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура застывания чистого вещества, например, олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться. В это время, при условии хорошей теплоизоляции, температура застывающего слитка не меняется и в точности совпадает с эталонной температурой, указанной в справочниках. Смеси веществ не имеют температуры плавления/отвердевания вовсе, и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса) . Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы (ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определенной температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления, с ростом температуры снижается вязкость таких веществ, и чем ниже вязкость, тем более жидким становится материал.
К примеру, обычное оконное стекло – это переохлаждённая жидкость. За несколько столетий становится видно, что при комнатной температуре стекло на окне сползает вниз под действием гравитации и становится внизу толще. При температуре 500-600 этот же эффект можно наблюдать уже в течение нескольких суток.
Поскольку при плавлении объём тела меняется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм ртутного столба) называют точкой плавления.
Температуры плавления некоторых важных веществ:
песок (температура плавления (tпл) = 1710 °С) , глина (tпл от 1150 до 1787 °С) ,
температура плавления °C
водорода −259,2
кислорода −218,8
азота −210,0
этилового спирта −114,5
аммиака −77,7
ртути −38,87
льда (воды) +0
бензола +5,53
цезия +28,64
сахарозы +185
сахаринa +225
oловa +231,93
свинца +327,5
алюминия +660,1
серебра +960,8
золота +1063
железа +1535
платины +1769,3
корунда +2050
вольфрама +3410
В нашей лабораторной работе мы изучаем разделение смеси этилового спирта и воды, которая относится к классу азеотропных. Теперь посмотрим на график зависимости температур кипе-ния и конденсации график изобар , рис. 3.
Очень нужны ответы
Ну первое нужно знать температуру льда!
И дальше посчитать если я правильно помню физику, то надо нагреть до 100 градусов чтоб он испарился)
во втором вопросе говориться что при сжигание одинакового колличества газа и спирта газ даст в 2 раза больше энергии (тоесть в два раза горячее)
Из адсорбера выходит обезвоженный спиртовой пар при давлении 100-340 кПа и температуре 85-140 С. Часть обезвоженного пара используют для улучшения регенерации молекулярных сит на стадии десорбции, а из остальной части после конденсации получают спирт этиловый…
В какой последовательности происходит получение чистого дивинила?
Почему холодильник выдает холод??
Потому что он для этого придуман, электроэнергия превращается в холод
В дефлегматоре конденсируется метиловый спирт с небольшим количеством этилового спирта. Температура конденсации паров дистиллята tD 65,5оC. Температуру воды на входе в теплообменник примем 180С, на выходе 380С.
Тепловой насос, откачивает тепло из холодильника и передаёт его наружу, на радиатор для охлаждения.
При какой температуре произойдет конденсация пара?
Просмотрите фазовую диаграмму, там всё ясно нарисовано.
Отбор ректификационного этилового спирта из колонны 3 производят с одной из тарелок гребенки отбора спирта 62-й, 64-й, 66-йбражки 5 , где ее нагревают теплом конденсации водно-спиртовых паров бражной колонны 1 до температуры 75 С. Из подогревателя 5 …
Я так понимаю, вопрос идет о самогоноварении. И опасности отравления народной отравой метиловым спиртом (метанолом) .
Точно, метанол в 20 молярных %% в воде кипит при 82,0°C, хотя чистый метанол кипит при 64,6 ( http://ru.wikipedia.org/wiki/ ).
Водо-метанольный пар, поднимаясь по колонке, будет распадаться так, что водяной пар уйдет вверх, а метанол станет конденсироваться.
На чем основано такое мнение? Чисто на эксперименте и фактах:
Факт 1. Никогда за один раз не удается перегнать (ректификовать) этанол из браги. Требуется 4х перегонка.
Из этого факта следует, что при перегонках метанольная отрава не попадает в этаноловый отвод (84°C при t° кипения этанола 78°). Надежный факт?
Факт 2. Метанол остается в растворе по той причине, что больше ему некуда деваться с его 64,6° кипения. Именно это наблюдалось экспериментально при очистке жидкости для протирания рук, продаваемой повсеместно в Африке: если перед перегонкой четко наблюдаются две границы раздела метилового, этилового и пропилового спиртов в соотношении 200 : 500 : 300 мл/л той гадости, то максимум, что удавалось выгнать полезного продукта с использованием высококлассного профессионального оборудования, была неполная поллитра. И поллитра гадости. Что подтверждало тезис Михайло Васильевича о том, что ничего так просто не дается и не получается.
Вывод: метанол оседает в раствор раньше и, если высота колонки или отвод (отросток) сделаны не очень высоко, водяной пар будет уходить, а метанол оставаться, повышая свою концентрацию и, как следствие, температуру кипения раствора.
Вот тут наступает опасность: точка выхода водяного пара должна бы пойти выше и, если она останется на прежнем месте, в нее может попасть уже и метанол. Надо ставить градусник и контролировать температуру отвода, либо снижать уровень более горячего теперь раствора, чтобы распределение температуры по колонке оставалось прежним.
Как и что получится, расскажи. Но с первого раза — вряд ли…
Оставшегося газа не будет (разве что растворённый воздух и примеси) . Сначала конденсируется высококипящий
Свойства белого фосфора, его нахождение в природе? помогите пожалуйста! помогите пожалуйста!
В Яндексе 2 миллиона ответов. Чё,блин, мучаешь людей…
Давлении температура кипения воды составляет 1000С, в то время как безводного этилового спирта 780С, тем самым делая спирт более летучим, иПринцип частичной конденсации паров с целью их максимального укрепления спиртом применяется во всех существующих…
История открытия
Первым в свободном состоянии фосфор получил в 1669 гамбургский алхимик Х. Бранд (есть сведения, что аналогичное по свойствам вещество было получено еще в 12 веке арабским алхимиком Бехилем) . В поисках философского камня он прокалил в закрытом сосуде сухой остаток от выпаривания мочи с речным песком и древесным углем. После прокаливания сосуд c реагентами начал светиться в темноте белым светом (это светился фосфор, восстановленный из его соединений, содержащихся в моче) .
В 1680 светящийся в темноте фосфор (от греческого «фосфорос» — светоносный) получил англичанин Р. Бойль. В последующие годы было установлено, что фосфор содержится не только в моче, но и в тканях головного мозга, в костях скелета. Наиболее простой метод получения фосфора прокаливанием костяной золы с углем был предложен в 1771 К. Шееле. Элементарную природу фосфора установил в конце 18 века А. Л. Лавуазье.
Нахождение в природе
Содержание в земной коре 0,105% по массе, что значительно превосходит содержание, например, азота. В морской воде 0,07 мг/л. В свободном виде в природе фосфор не встречается, но он входит в состав 200 различных минералов. Наиболее известны фосфорит кальция Са3(РО4) 3, апатиты (фторапатит 3Са3 (РО4 ) 3 ·СаF2, или, Ca5 (PO 4 )3F), монацит, бирюза. Фосфор входит в состав всех живых организмов.
Элементарный фосфор существует в нескольких аллотропных модификациях, главные из которых: белая (фосфор III), красная (фосфор II) и черная (фосфор I).
Белый фосфор — воскообразное, прозрачное вещество, с характерным запахом. Состоит из тетраэдрических молекул Р4, которые могут свободно вращаться. Белый фосфор обладает кубической кристаллической решеткой молекулярного типа, параметр ячейки а = 1,851 нм. Плотность 1,828 кг/дм3. Температура плавления 44,14°C, температура кипения 287°C. Существует две формы белого фосфора: a-модификация, с кубической кристаллической решеткой, при –76,9°C переходит в b-модификацию, кристаллическая решетка которой не установлена и отсутствует свободное вращение молекул Р4. Диэлектрик. Растворяется в этиловом спирте, бензоле, сероуглероде CS2.
Нагревая белый фосфор без доступа воздуха при 250-300°C получают красный фосфор. Примеси натрия, иода и селена и УФ-лучи ускоряют переход одной модификации в другую. Белый фосфор используется при изготовлении фосфорной кислоты Н3РО4 (для получения пищевых фосфатов и синтетических моющих средств) . Применяется при изготовлении зажигательных и дымовых снарядов, бомб.
.Сухой спирт есть. Говорят, сухую водку придумали?! Чем же она пахнет?
Ничем не пахнет. Это просто порошок.
С ними единую паровую смесь с концентрацией спирта в них Y, которую можно определить только после конденсации этих паров т.е. в жидкости как в предыдущем случае илиРис.3 Зависимость температуры кипения этилового спирта-ректификата от атмосферного давления.
“сухой спирт” к спиртам не относится. “Сухим спиртом” называется продукт конденсации аммиака с формалином – совсем невкусный азотистый гетероцикл гексаметилентетрамин.
Настоящий сухой спирт – замороженный до твердого состояния этиловый спирт тоже лучше не пробовать – он твердый при криогенных температурах, горло можно простудить 🙂
На складе оборудования имеется кожухотрубчатый теплообменник,
Вот это самогонный аппарат, тут одним бидоном не обойдешся
В известном аппарате процесс конденсации пара на внешней поверхности трубок 4 приводит к росту концентрации этилового спирта и снижению температуры в межтрубном пространстве…
У кого есть конструкция самогоного аппарата, желательно чертежи.
Туточки посмотри. Правда, картинки только после регистрации будут видны, как и везде.
Температура кипения 64,509оС. Бесцветная жидкость. Этиловый спирт.Температура конденсации паров дистиллята tD 65,5оC. Температуру воды на входе в теплообменник примем 180С, на выходе 380С.
Люди помогите…мне нужно сообщение а метаноле химия 10 класс??
Что делать, что бы яблоки не гнили
Их нужно завернуть в газету они так дольше хранятся. А потом в холодильник или на балкон
Спирт этиловый-сырец и спирт этиловый питьевой 95 %-ный не имеют ни какойВ разные периоды температура брожения поддерживается на уровне 25-30 0С, для чего в бродильныхПри нагревании летучая фракция будет переходить в паровую фазу и после конденсации…
Скушать их все.
Гнание самогона можно отнести к химическому процессу?
Безусловно!!!
Все дело в том, что температура кипения спирта ниже, чем температура кипения воды. Соответственно, нагревая герметичный перегонный куб, перегоняемая жидкость брага начинается нагреваться и поступать в самогонный аппарат для последующей конденсации…
Да, у меня друг в универе даже дипломную по химии защищал, на тему “перегон различного сырья в самогон на примере сосновых опилок”)))
Я бы сказал к физическому, ИМХО так будет правильнее
Можно наверно… а напиток отличный!
Нет, это скорее народное ремесло.
Вы ошибаетесь – это истинно творческий процесс
Имеющих различную температуру кипения путем многоступенчатого испарения и конденсации потоков веществ, движущихся относительно друг друга 86 ректификация спирта-сырца – получение ректификованного этилового спирта из этилового…
Да это химический процесс, но дальше без 100 грамм не разобраться!
“Гнание” – это дистилляция, физический метод разделения гомогенной смеси веществ, используемый в химии и химической технологии.
Это физический процес, связанный с различием в температуре кипения спирта, сивушных масел и воды. Вот процес брожения – биохимический.
Строение белого и красного фосфора. Сравните строение белого и красного фосфора.Строение и физические свойства
diamed-mbs.ru